VII. Data Pengamatan
7.1 Kromatografi Lapis
Tipis
Perlakuan
|
Pengamatan
|
Disiapkan plat TLC
|
|
Sampel yang akan diuji diekstraki dengan metanol:
a. Buah naga
b. Bayam
c. Nanas
d. Kembang kertas
e. Semangka
f. Wortel
g. Pepaya
h. Kentang
i. Tomat
j. Kembang sepatu
|
Hasil dari ekstraksi sampel dengan metanol yaitu:
a. Larutan berwarna merah keunguan
b. Larutan berwarna hijau
c. Larutan berwarna kuning
d. Larutan berwarna merah pudar
e. Larutan berwarna merah jernih
f. Larutan berwarna oren
g. Larutan berwarna oren
h. Larutan berwarna coklat pudar
i. Larutan berwarna oren pudar
j. Larutan berwarna merah
|
Sampel yang telah diekstraksi ditotolkan ke plat TLC kemudian plat
dimasukkan kedalam chamber yang berisi eluen (n-heksana : etil asetat = 2 ml
: 1 ml). Diukur noda yang bergerak
a. Buah naga
b. Bayam
c. Nanas
d. Kembang kertas
e. Semangka
f. Wortel
g. Pepaya
h. Kentang
i. Tomat
j. Kembang sepatu
|
a. Noda bergerak dengan jarak noda 3,9 cm dan
jarak pelarut 4,8 cm
b. Jarak noda 0,3 cm dan jarak pelarut 4,8 cm
c. Jarak noda 3,8 cm dan jarak pelarut 4,8 cm
d. Jarak noda 2,5 cm dan jarak pelarut 4,8 cm
e. Jarak noda 3,7 cm dan jarak pelarut 4,5 cm
f. Jarak noda 3,9 cm dan jarak pelarut
4,5 cm
g. Jarak noda 3,8 cm dan jarak pelarut 4,5 cm
h. Jarak noda 0 cm dan jarak pelarut 4,5 cm
i. Jarak noda 4,1 cm dan jarak
pelarut 4,7 cm
j. Jarak noda 4 cm dan jarak
pelarut 4,7 cm
|
|
|
8.2 Kromatografi Kolom
No
|
Perlakuan
|
Pengamatan
|
1.
|
Disiapkan
alat kromatografi kolom dan dimasukkan kapas serta ditetesi n-heksane
|
Kapas
memadat dalam kolom dan n-heksane membersihkan kapas yang ketinggalan di
kolom.
|
2.
|
Dicampurkan
silika gel dengan larutan n-heksana yang kemudian dimasukkan kedalam kolom
secara terus menerus hingga memadat
|
Silika gel
yang dimasukkan kedalam kolom dipadatkan hingga setengah bagian dari kolom
|
3.
|
Dicawan
petri dimasukkan 1 sudip silika gel dan ditetesi dengan sampel (sambil
diaduk)
|
Sampel
menjadi kering dan bercampur antara silika dan senyawa sampel.
|
4.
|
Dimasukkan
kedalam kolom. Dan di masukkan
|
|
5.
|
Dilakukan
untuk 10 sampel tanaman yang berbeda.
|
Sampel A
(buah naga)
Dilakukan
kromatografi kolom seperti perlakuan diatas
|
1.
|
Disiapkan pelarut n-heksane :etil asetat = 8 : 1. Dimasukkan secara
terus menerus dan perlahan
Disiapkan wadah untuk pelarut yang turun.
|
Diperoleh
bahwa pelarut turun secara perlahan namun sampel tidak turun
|
2.
|
Ditambahkan pelarut kembali yaitu pelarut n-heksane :etil asetat = 16 :
2. Disiapkan wadah pelarut yang turun. Ditetesi pelarut perlahan
|
Diperoleh
sampel sedikit turun diikuti pelarut yang habis.
|
3.
|
Ditambahkan
pelarut kembali yaitu pelarut n-heksane :etil asetat = 16 : 2. Disiapkan
wadah pelarut yang turun. Ditetesi pelarut perlahan
|
Diperoleh
sampel turun setengah kolom
|
4.
|
Ditambahkan
pelarut kembali yaitu pelarut n-heksane :etil asetat = 15 : 5. Disiapkan
wadah pelarut yang turun. Ditetesi pelarut perlahan
|
Larutan
sampel sedikit menurun.
Sampel dalam
silika berwarna bening
|
5.
|
Dibiarkan
sampel menguap dalam botol. Kemudian di berikan 1 tetes methanol
|
Diperoleh 5
botol sampel
|
6.
|
Dilakukan
TLC
Digaris
kertas pada plat TLC 0,5 cm sebanyak 5 garis
Diteteskan,
(ditotolkan) 5 tetes sampel dan 1 tetes crude sampel pada plat tetes.
Kemudian dimasukkan kedalam eluen yaitu n-heksana : etil asetat dengan
perbandingan 3 : 2.
|
Diperoleh
bahwa sampel crude (Sampel asli) bergerak. Namun sampel yang sudah dilakukan
kromatografi kolom tidak bergerak.
|
Sampel B
(Bayam)
Dilakukan
kromatografi kolom seperti perlakuan diatas
|
1.
|
Disiapkan
pelarut n-heksane : etil asetat = 5 : 10. Dimasukkan secara terus menerus dan
perlahan
Disiapkan
wadah untuk pelarut yang turun.
|
Hasil sampel
turun didasar kolom, diperoleh:
Botol I :
bening
Botol II :
hijau
Botol III :
hijau pudar
Botol IV :
bening
Dimana
sampel yang dikolom pada silika mengering berwarna kuning.
|
2.
|
Dibiarkan
sampel menguap dalam botol. Kemudian di berikan 1 tetes metanol.
|
|
3.
|
Dilakukan
TLC
Digaris
kertas pada plat TLC 0,5 cm sebanyak 5 garis
Diteteskan, (ditotolkan) 5 tetes sampel dan 1 tetes crude sampel pada
plat tetes. Kemudian dimasukkan kedalam eluen yaitu n-heksana : etil asetat
dengan perbandingan 3 : 2
|
Diperoleh bahwa tidak ada sampel yang bergerak. Pada botol 1,2 dan 3
pada plat berwarna kuning.
|
Sampel C
(Nanas)
Dilakukan
kromatografi kolom seperti perlakuan diatas
|
1.
|
Disiapkan
pelarut kloroform : metanol = 3 : 1. Dimasukkan secara terus menerus dan
perlahan
Disiapkan
wadah untuk pelarut yang turun.
|
Diperoleh sampel:
Botol I : berwarna bening
Botol II : silika pecah namun nanas turun menjadi keruh.
Botol III : bening keruh
|
2.
|
Dibiarkan
sampel menguap dalam botol. Kemudian di berikan 1 tetes metanol.
|
|
3.
|
Dilakukan
TLC
Digaris
kertas pada plat TLC 0,5 cm sebanyak 5 garis
Diteteskan,
(ditotolkan) 5 tetes sampel dan 1 tetes crude sampel pada plat tetes.
Kemudian dimasukkan kedalam eluen yaitu kloroform : metanol dengan
perbandingan 2 : 1.
|
Tidak bergerak dan tidak berwarna
|
Sampel D (Bunga Kertas)
Dilakukan kromatografi kolom seperti perlakuan diatas
|
1.
|
Disiapkan
pelarut kloroform. Dimasukkan secara terus menerus dan perlahan
Disiapkan
wadah untuk pelarut yang turun.
|
Diperoleh hasil :
Botol I : Bening
Botol II : Bening berminyak
Botol III : Agak keruh
BotolIV : Bening
Botol V : Bening
Silika sampel berwarna hijau semakin lama semakin turun dan
hilang.
|
2.
|
Dibiarkan
sampel menguap dalam botol. Kemudian di berikan 1 tetes metanol.
|
|
3.
|
Dilakukan
TLC
Digaris
kertas pada plat TLC 0,5 cm sebanyak 5 garis
Diteteskan,
(ditotolkan) 5 tetes sampel dan 1 tetes crude sampel pada plat tetes.
Kemudian dimasukkan kedalam eluen yaitu metanol 100 %.
|
Fasa gerak
hanya terjadi pada crude atau sampel asli. Pada plat terdapat warna cream
disepanjang jarak dan dibagian tengahnya berwarna ungu.
|
Sampel E
(Semangka)
Dilakukan
kromatografi kolom seperti perlakuan diatas
|
1.
|
Disiapkan
pelarut n-heksane : etil asetat = 3 : 2. Dimasukkan secara terus menerus dan
perlahan
Disiapkan
wadah untuk pelarut yang turun.
|
Sampel dalam
kolom di silika langsung turun. Diperoleh hasil bahwa:
Botol I :
Bening
Botol II :
Kuning Pudar
Botol III :
Bening
|
2.
|
Dibiarkan
sampel menguap dalam botol. Kemudian di berikan 1 tetes metanol.
|
|
3.
|
Dilakukan
TLC
Digaris
kertas pada plat TLC 0,5 cm sebanyak 5 garis
Diteteskan,
(ditotolkan) 5 tetes sampel dan 1 tetes crude sampel pada plat tetes.
Kemudian dimasukkan kedalam eluen yaitu n-heksana : etil asetat dengan
perbandingan 3 : 2
|
Pada plat
terlihat bahwa hanya crude (sampel asli) yang bergerak dengan warna kuning.
Namun pada hasil yang diperoleh pada saat kolom tidak terdapat fasa gerak.
|
Sampel F
(Wortel)
Dilakukan
kromatografi kolom seperti perlakuan diatas
|
1.
|
Disiapkan
pelarut n-heksane : etil asetat = 3 : 2. Dimasukkan secara terus menerus dan
perlahan
Disiapkan
wadah untuk pelarut yang turun.
|
Diperolh
hasil bahwa:
Botol I :
sampel udah turun berwarnna bening
Botol II :
Kuning cerah
Botol III :
Bening
|
2.
|
Dibiarkan
sampel menguap dalam botol. Kemudian di berikan 1 tetes metanol.
|
|
3.
|
Dilakukan
TLC
Digaris
kertas pada plat TLC 0,5 cm sebanyak 5 garis
Diteteskan,
(ditotolkan) 5 tetes sampel dan 1 tetes crude sampel pada plat tetes.
Kemudian dimasukkan kedalam eluen yaitu n-heksana : etil asetat dengan
perbandingan 3 : 2
|
Pada crude
terjadi fasa gerak dengan warna kuning. Namun pada hasil kromatografi kolom
pada botol I dan III tidak bergerak namun terdapat warna cream. Sedangkan
pada botol II tidak terjadi apa-apa.
|
Sampel G
(Pepaya)
Dilakukan
kromatografi kolom seperti perlakuan diatas
|
1.
|
Disiapkan
pelarut n-heksane : etil asetat = 3 : 2. Dimasukkan secara terus menerus dan
perlahan
Disiapkan
wadah untuk pelarut yang turun.
|
Diperoleh:
Botol I :
Bening (Sampel belum turun)
Botol II :
Kuning (Sampel turun)
Botol III :
Bening (Sampel turun)
Botol IV :
Bening
|
2.
|
Dibiarkan
sampel menguap dalam botol. Kemudian di berikan 1 tetes metanol.
|
|
3.
|
Dilakukan
TLC
Digaris
kertas pada plat TLC 0,5 cm sebanyak 5 garis
Diteteskan,
(ditotolkan) 5 tetes sampel dan 1 tetes crude sampel pada plat tetes.
Kemudian dimasukkan kedalam eluen yaitu n-heksana : etil asetat dengan
perbandingan 3 : 2
|
Pada plat
terlihat bahwa crude terjadi fasa gerak berwarna orange.
Botol I : tidak
terjadi apa-apa
Botol II :
tidak bergerak tetapi terdapat warna cream pudar
Botol III :
bergerak dengan warna cream
Botol IV
: tidak bergerak tetapi ada warna cream pudar pada plat
|
Sampel H
(Kentang)
Dilakukan
kromatografi kolom seperti perlakuan diatas
|
1.
|
Disiapkan
pelarut kloroform : metanol = 3 : 1. Dimasukkan secara terus menerus dan
perlahan
Disiapkan
wadah untuk pelarut yang turun.
|
Diperoleh
hasil :
Botol I :
bening ( setengah botol)
Botol II :
kuning keruh ( seperdelapan botol)
Botol III :
bening
Botol IV :
bening
|
2.
|
Dibiarkan
sampel menguap dalam botol. Kemudian di berikan 1 tetes metanol.
|
|
3.
|
Dilakukan
TLC
Digaris
kertas pada plat TLC 0,5 cm sebanyak 5 garis
Diteteskan,
(ditotolkan) 5 tetes sampel dan 1 tetes crude sampel pada plat tetes.
Kemudian dimasukkan kedalam eluen yaitu kloroform : metanol dengan
perbandingan 2 : 1.
|
Pada plat
terdapat fasa gerak pada crude namun pada sampel hasi kromatografi kolom
tidak terjadi apa-apa.
|
Sampel I
(Tomat)
Dilakukan
kromatografi kolom seperti perlakuan diatas
|
1.
|
Disiapkan
pelarut n-heksane : etil asetat = 3 : 1. Dimasukkan secara terus menerus dan
perlahan
Disiapkan
wadah untuk pelarut yang turun.
|
Diperoleh
hasil bahwa :
Botol I :
berwarna bening
Botol II :
berwana kemerahan
Botol III :
bening
|
2.
|
Dibiarkan
sampel menguap dalam botol. Kemudian di berikan 1 tetes metanol.
|
|
3.
|
Dilakukan
TLC
Digaris
kertas pada plat TLC 0,5 cm sebanyak 5 garis
Diteteskan, (ditotolkan)
5 tetes sampel dan 1 tetes crude sampel pada plat tetes. Kemudian dimasukkan
kedalam eluen yaitu n-heksana : etil asetat dengan perbandingan 3 : 2
|
Pada plat
diperoleh bahwa botol III bergerak dan berwarna bu-abu.
|
Sampel J
(Bunga sepatu)
Dilakukan
kromatografi kolom seperti perlakuan diatas
|
1.
|
Disiapkan
pelarut n-heksane : etil asetat = 3 : 1. Dimasukkan secara terus menerus dan
perlahan
Disiapkan
wadah untuk pelarut yang turun.
|
Diperoleh
hasil :
Botol I :
bening
Botol II :
keruh
Botol III:
keruh pudar
|
2.
|
Dibiarkan
sampel menguap dalam botol. Kemudian di berikan 1 tetes metanol.
|
|
3.
|
Dilakukan
TLC
Digaris
kertas pada plat TLC 0,5 cm sebanyak 5 garis
Diteteskan,
(ditotolkan) 5 tetes sampel dan 1 tetes crude sampel pada plat tetes.
Kemudian dimasukkan kedalam eluen yaitu n-heksana : etil asetat dengan
perbandingan 3 : 2
|
Pada plat
tidak terjadi fasa gerak tetapi terdapat warna cream.
|
|
|
|
|
VIII. Pembahasan
Kromatografi merupakan salah satu teknik pemisahan
yang cukup banyak digunakan para peneliti dalam melakukan pemisahan suatu
sampel dengan adanya fase gerak dan juga fase diamnya. Kromatografi memiliki
macam-macamnya meliputi, kromatografi lapis tipis, kromatografi cair,
kromatografi gas, kromatografi penukar ion, kromatografi afinitas, dimana semua
teknik kromatografi tersebut menggunakan prinsip yang sama. Prinsip dasar dari
pemisahan kromatografi yaitu jika suatu komponen penyusun zat terletak pada
perbedaan afinitas (gaya adesi) dari setiap jenis sampel terhadap perbandingan
fasa diam dan fasa gerak sehingga masing-masing zat tersebut mampu terpisah
satu sama lain. Dalam menentukan afinitas analit dipengaruhi oleh daya
adsorpsinya terhadap fasa diam dan kelarutan analit tersebut terhadap
penggunaan fasa gerak. Jika makin kuat adsorpsi suatu analit terhadap fasa
diamnya dan pada kelarutannya yang kecil terhadap pasa gerak maka waktu untuk
diam dalam kolomnya lebih lama dibandingkan dengan analit yang memiliki daya
adsorpsinya kecil terhadap fasa diam tetapi memiliki kelarutannya sangat besar
dengan fasa gerak yang digunakan.
Pada percobaan ini praktikan melakukan percobaan
kromatografi lapis tipis dan kromatografi kolom. Pada percobaan ini praktikan
juga menggunakan 10 sampel tanaman yang berbebeda-beda, yaitu sampel buah naga,
sampel bayam, sampel nanas, sampel bunga kertas, sampel semangka, sampel
wortel, sampel pepaya, sampel tomat dan sampel bunga sepatu. Sedangkan eluen
yang digunakan pada percobaan ini, yaitu metanol, kloroform, etil asetat dan n-heksane.
Dari banyaknya sampel dan banyaknya pelarut yang digunakan maka praktikan diharapkan
bisa mendapatkan nilai Rfnya dari sampel tersebut dan hasil yang diperoleh
melaui kromatografi kolom yang kemudian dilakukan kromatografi lapis tipis
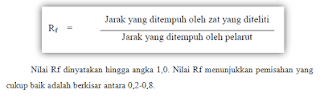
kembali untuk mengetahui kuantitas yang terkandung dalam sampel tersebut. Rumus
mencari nilai Rf, yaitu sebagai berikut: (http://syamsurizal.staff.unja.ac.id/2019/04/10/325teknik-pemisahan-dengan-khromatografi/).
1.
Kromatografi Lapis Tipis (TLC)
Kromatografi lapis tipis merupakan suatu cara pemisahan campuran senyawa
menjadi senyawa murninya dan mengetahui kuantitas yang terkandung dalam senyawa
yang dianalisis. Percobaan kali ini dilakukan bertujuan untuk mengetahui nilai
Rfnya.
Pada percobaan ini, teknik kromatografi lapis tipis
yang digunakan adalah suatu plat tipis (alumunium) yang berfungsi sebagai
tempat berjalannya adsorben sehingga proses perpindahan (migrasi) suatu sampel
(analit) oleh suatu pelarut (solvent) yang bisa berjalan. Persiapan plat yang
digunakan, yaitu dengan memotong plat tersebut pada ukuran 5 x 3 cm , kemudian
dikasih batas bawah dari plat untuk penotolan sampel sebesar 0,5 cm. Dari 10
sampel yang digunakan yaitu sampel buah naga, sampel bayam, sampel nanas,
sampel bunga kertas, sampel semangka, sampel wortel, sampel pepaya, sampel
tomat dan sampel bunga sepatu diambil ekstraknya. Dimana tiap-tiap sampel
dilakukan ekstraksi menggunakan padat-cair. Maksudnya sampel padat di tumbuk
atau dihaluskan menggunakan porselen dan di peras dan diambil ekstrak dari
masing-masing sampel. Dan setelah diperoleh sampel murni dan kemudian ditetesi
sebanyak 5 tetes metanol pada tiap-tiap sampel. Persiapan sampel telah selesai.
Kemudian dilanjutkan dengan persiapan eluen (pelarut) yaitu metanol, kloroform, etil asetat dan
n-heksane. Dimana kami menggunakan beberapa campuran dari tiap-tiap sampel
sesuai dengan kepolarannya.
Pada
percobaan ini diawali dengan penotolan sampel pada plat TLC. Pada percobaan
pertama dengan plat (a) yang mengandung 4 sampel berbeda yaitu buah naga,
bayam, nanas, dan bunga kertas. Masing-masing sampel ditotol pada garis 0,5 cm
dari dasar secara vertikal. Kemudian plat dimasukkan kedalam chamber yang
berisi eluen emudian chamber ditutup rapat agar eluen tidak menguap karena
eluen yang kami gunakan bersifat mudah menguap. Dimana eluen yang kami gunakan
yaitu perbandingan eluen n-heksane dan Etil asetat yaitu masing-masing 2 : 1.
Ditunggu beberapa saat hingga terlihat pergerakan sampel pada plat. Setelah
terjadi pergerakan diambil plat kemudian disinari dengan sinar UV pada telepon
genggam yang dimiliki salah satu praktikan. Dan diberi tanda menggunakan pensil
agar memperjelas jarak yang ditempuh sampel. Hasil yang didapat bahwa pada plat
(a) jarak pelarut sebesar 4,8 cm dan pada senyawa memiliki vasiasi yang sangat
signifikan yaitu pada sampel buah naga jarak senyawa sebesar 3,9 cm sehingga Rf
yang diperoleh sebesar 0,8125 dengan menggunakan rumus yang diatas telah
diberitahu. Rf (Retardation faktor) bertujuan untuk mengidentifikasi senyawa
dengan menghitung dan membandingkan harga Rf. Kemudian sampel kedua yaitu bayam
dimana jarak senyawa yang ditempuh sangat kecil sebesar 0,3 cm sehingga Rf nya
yaitu 0,0625. Sampel ketiga yaitu nanas memberkan jarak senyawa yang hampir
mirip dengan buah naga yaitu 3,8 cm sehingga Rf nya sebesar 0,7917 dan sampel
keempat yaitu bunga kertas diperoleh jarak senyawa sebesar 2,5 cm dan Rf nya
yaitu 0,521. Dari keempat sampel pada plat (a) memberikan variasi Rf yaitu buah
naga, nanas, bunga kertas dan bayam secara berturut-turut yaitu 0,8125 : 0,7917
: 0,521 : 0,0625.
Percobaan kedua pada plat (b) yaitu dengan empat sampel berbeda yaitu
semangka, wortel, pepaya dan kentang. Dengan perbandingan eluen tetap 2 : 1
namun dengan komposisi yang berbeda dengan plat (a) yaitu 1 ml n-heksane dan
0,5 ml etil asetat. Hal yang sama seperti perlakuan plat (a). Diawali dengan
penotolan keempat sampel pada plat dan dicelupkan pada eluen pada chamber. Dan
diamati menggunakan sinar UV dan diukur pada masing-masing sampel. Hasil yang
diperoleh plat (b) yaitu pada jarak
pelarut sebesar 4,5 cm dan jarak masing-masing sampel yaitu pertama semangka
dengan jarak senyawa sebesar 3,7 cm maka Rf nya sebesar 0,82. Kedua pada sampel
wortel dimana jarak senyawa sebesar 3,9 cm maka Rf nya 0,87 dan sampel ketiga
yaitu pepaya dengan jarak senyawa sebesar 3,8 cm maka Rf nya menjadi 0,84 dan
terakhir pada plat (b) yaitu sampel kentang yang meberikan jarak senyawa nol
atau dikatakan senyawa tidak memberikan pergerakan pada plat sehingga
berbanding lurus dengan tidak memberikan
nilai Rf. Hal ini dapat disebabkan karena salah perlakuan dari peneliti
ataupun senyawa kentang yang sudah tidak murni lagi. Diperoleh nilai Rf yang
relatif sama tidak berbeda pada ketiga sampel yaitu semangka, wortel dan pepaya
tidak halnya pada kentang.
Percobaan selanjutnya pada plat (c) dengan 2 sampel saja yang berbeda
yaitu tomat dan kembang sepatu. Dengan eluen yang digunakan yaitu n-heksane :
etil asetat yaitu 3 : 1, dimana 3 ml n-heksane dan 1 ml etil asetat. Hal yang
sama seperti perlakuan pada plat (a) dan plat (b). Maka hasil yang diperoleh
pada jarak pelarut sebesar 4,7 cm dan jarak senyawa pada sampel tomat sebesar
4,1 cm maka harga Rf nya 0,872 dan pada sampel kedua yaitu kembang sepatu
dengan jarak senyawa sebesar 4 cm sehingga harga Rf nya 0,85.
Diperoleh variasi harga Rf (Retardation faktor) dari 10 sampel tersebut.
Hal-hal yang mempengaruhi adalah kandungan atau kuantitas dari masing-masing
sampel dan banyaknya eluen atau perbandingan eluen dengan masing-masing
kepolarannya. Faktor lain yang mempengaruhi yaitu kurangnya ketelitian dari
peneliti dan kurangnya pemahaman peneliti dalam melakukan percobaan ini pada
komposisi masing-masing eluen yang digunakan.
2. Kromatografi
Kolom
Kromatografi kolom yang kami gunakan yaitu kromatografi cair-padat (KCP)
kolom terbuka. Pemisahan kromatografi kolom berdasarkan pada adsorbsi
komponen-komponen campuran dengan afinitas berbeda-beda terhadap permukaan fase
diam. Substrat padat (adsorben) bertindak sebagai fase diam yang sifatnya tidak
larut dalam fase cair. Fase geraknya berupa cairan (pelarut) yang mengalir akan
membawa komponen campuran sepanjang kolom. Prinsip yang mendasari kromatografi
kolom adsorpsi adalah komponen-komponen dalam zat yang harus diteliti mempunyai
afinitas yang berbeda-beda terhadap adsorben dalam kolom.
Percobaan diawali dengan penyiapan kolom dengan memasukkan kapas pada
kolom yang bertujuan untuk menyumbatnya, kemudian ditetesi dengan n-heksane
yang bertujuan untuk membersihkan kapas yang nempel pada dinding kolom
tersebut. Pada kolom terlebih dahulu silika gel sebagai adsorben atau substrat
padat yang bertindak sebagai fase diam yang sifatnya tidak larut dalam fase
cair. Sedangkan fase geraknya yang kami gunakan yaitu n- heksane, dimana
n-heksane merupakan cairan (pelarut) yang akan mengalir dan mebawa komponen
campuran sepanjang kolom. Selanjutnya disiapkan antara adsorben dan cairan
(pelarut) pada suatu tempat kemudian dicampurkan. Kemudian kolom diisikan
dengan silika gel dan n-heksane bertujuan untuk pelarutan dan penjernihan
kemudian dimasukkan secara secara
perlahan-lahan dan hati-hati serta terus menerus hingga adsorben berada
disetengah kolom hingga padat atau menjenuhkan kolom. Dengan cara mengetuk
datar dan searah pada bagian dinding hingga tidak ada lagi yang bergerak
menetes namun pelarut dalam kolom akn tetap menetes.
Kemudian, penyiapan sampel yaitu dengan mencampurkan senyawa murni pada
10 sampel yang berbeda meliputi meliputi sampel buah naga, sampel bayam, sampel
nanas, sampel bunga kertas, sampel semangka, sampel wortel, sampel pepaya,
sampel tomat dan sampel bunga sepatu. Dilanjutkan dengan mencampurkan
masing-masing sampel pada silika gel, dengan beberapa tetes sampel saja dan
diaduk hingga kering pada cawan petri. Kita hanya menggunakan per sampel tidak
menggabungkan beberapa sampel. Kemudian sampel tersebut dimasukkan kedalam
kolom dan diratatakan sambil ditetesi dengan dengan campuran dua pelarut
tergantung pada sampel dan banyaknya pelarut bergantung pada kepolaran
masing-masing pelarut. Hasil yang diperoleh berbeda-beda pada setiap sampel
dengan masing-masing eluen yang digunakan sebagai berikut:
v Pada sampel pertama yaitu buah naga dengan pelarut
yang digunakan yaitu n-heksane : etil asetat dengan perbandingan 8:1. Kemudian kolom yang telah terisi dengan
silika gel yang memadat ditambahkan sampel buah naga yang kering dan tetesi
dengan pelarut tersebut secara perlahan. Kemudian pelarut yang keluar
dimasukkan kedalam botol-botol kecil deiperoleh sampel pelarut tetapi sampel
tidak turun. Oleh sebab sampel tidak turun maka dilanjutkan dengan penambahan
pelarut yang sama sebanyak 16:2. Hasilnya sampel turun sedikit, hingga
diperoleh ampel pelarut kembali. Diulangi dengan pelarut dan perbandingan yang
sama diperoleh hasil bahwa sampel turun setengah. Sampel yang tidak turun-turun
dilakukan kembali hal yang sama dengan pelarut tersebut dengan perbandingan
yang berbeda yaitu 15:5. Diperoleh bahwa
sampel sedikit menurun. Diperoleh 5 botol sampel berwarna bening. Setiap botol
dibiarkan menguap dan kemudian ditetesi dengan metanol kemudian dilanjutkan
dengan kromatografi lapis tipis. Proses
TLC diawali dengan menggaris kertas pada plat TLC 0,5 cm sebanyak 5 garis.
Diteteskan, (ditotolkan) 5 tetes sampel dan 1 tetes crude sampel pada plat
tetes. Kemudian dimasukkan kedalam eluen yaitu n-heksana : etil asetat dengan
perbandingan 3 : 2. Diperoleh pada proses TLC yaitu hanya crude (sampel asli)
yang bergerak. Sedangkan sampel asil kromatografi kolom tidak.
v Pada sampel kedua yaitu bayam diawali dengan
menyiapkan pelarut n-heksane : etil asetat = 5 : 10. Kemudian kolom yang telah
terisi dengan silika gel yang memadat ditambahkan sampel bayam yang kering dan
tetesi dengan pelarut tersebut secara perlahan. Dimasukkan secara terus menerus
dan perlahan pada kolom. Disiapkan wadah untuk pelarut yang turun. Diperoleh
bahwa hasil sampel turun didasar kolom, diperoleh: Botol I : bening, Botol II :
hijau, Botol III : hijau pudar, Botol IV : bening. Dimana sampel yang dikolom
pada silika mengering berwarna kuning. Setiap botol dibiarkan menguap dan
kemudian ditetesi dengan metanol kemudian dilanjutkan dengan kromatografi lapis
tipis.Kemudian dilakuakn TLC seperti prosedur yang sama diperoleh bahwa tidak
ada sampel yang bergerak. Namun pada botol 1,2 dan 3 pada plat berwarna kuning.
v Pada sampel ketiga yaitu nanas. Disiapkan pelarut
kloroform : metanol = 3 : 1.Kemudian kolom yang telah terisi dengan silika gel
yang memadat ditambahkan sampel nanas yang kering dan tetesi dengan pelarut
tersebut secara perlahan. Dimasukkan secara terus menerus dan perlahan.
Disiapkan wadah untuk pelarut yang turun. Diperoleh sampel: Botol I : berwarna
bening, Botol II : silika pecah namun sampel nanas turun menjadi keruh dan
Botol III : bening keruh. Setiap botol dibiarkan menguap dan kemudian ditetesi
dengan metanol kemudian dilanjutkan dengan kromatografi lapis tipis. Kemudian
dilakuakn TLC dimasukkan kedalam eluen yaitu kloroform : metanol dengan
perbandingan 2 : 1. seperti prosedur yang sama diperoleh bahwa tidak bergerak
dan tidak berwarna.
v Pada sampel keempat yaitu bunga kertas. Disiapkan
pelarut kloroform.Kemudian kolom yang telah terisi dengan silika gel yang
memadat ditambahkan sampel bunga kertas yang kering dan tetesi dengan pelarut
tersebut secara perlahan. Dimasukkan secara terus menerus dan perlahan
Disiapkan wadah untuk pelarut yang turun. Diperoleh hasil : Botol I : Bening,
Botol II : Bening berminyak, Botol III : Agak keruh, Botol IV : Bening, dan Botol
V : Bening. Silika sampel berwarna hijau
semakin pudar. Setiap botol dibiarkan menguap dan kemudian ditetesi dengan
metanol kemudian dilanjutkan dengan kromatografi lapis tipis. Hasilnya, fasa
gerak hanya terjadi pada crude atau sampel asli. Pada plat terdapat warna cream
disepanjang jarak dan dibagian tengahnya berwarna ungu.
v Pada sampel keenam yaitu semangka. Disiapkan pelarut
n-heksane : etil asetat = 3 : 2. Kemudian kolom yang telah terisi dengan silika
gel yang memadat ditambahkan sampel bunga kertas yang kering dan tetesi dengan
pelarut tersebut secara perlahan Dimasukkan secara terus menerus dan perlahan.
Disiapkan wadah untuk pelarut yang turun. Sampel dalam kolom di silika langsung
turun. Diperoleh hasil bahwa: Botol I : Bening, Botol II : Kuning Pudar dan
Botol III : Bening. Setiap botol dibiarkan menguap dan kemudian ditetesi dengan
metanol kemudian dilanjutkan dengan kromatografi lapis tipis. Hasilnya, Pada
plat terlihat bahwa hanya crude (sampel asli) yang bergerak dengan warna
kuning. Namun pada hasil yang diperoleh pada saat kolom tidak terdapat fasa
gerak.
v Pada sampel selanjutnya yaitu wortel. Disiapkan
pelarut n-heksane : etil asetat = 3 : 2. Kemudian kolom yang telah terisi
dengan silika gel yang memadat ditambahkan sampel bunga kertas yang kering dan
tetesi dengan pelarut tersebut secara perlahan Dimasukkan secara terus menerus
dan perlahan. Disiapkan wadah untuk pelarut yang turun. Diperolh hasil bahwa:
Botol I : sampel udah turun berwarnna bening, Botol II : Kuning cerah, dan
Botol III : Bening. Setiap botol dibiarkan menguap dan kemudian ditetesi dengan
metanol.kemudian dilanjutkan dengan kromatografi lapis tipis. Pada crude
terjadi fasa gerak dengan warna kuning. Namun pada hasil kromatografi kolom
pada botol I dan III tidak bergerak namun terdapat warna cream. Sedangkan pada
botol II tidak terjadi apa-apa.
v Pada sampel selanjutnya yaitu pepaya. Disiapkan
pelarut n-heksane : etil asetat = 3 : 2. Kemudian kolom yang telah terisi
dengan silika gel yang memadat ditambahkan sampel bunga kertas yang kering dan
tetesi dengan pelarut tersebut secara perlahan Dimasukkan secara terus menerus
dan perlahan. Disiapkan wadah untuk pelarut yang turun. Diperoleh: Botol I :
Bening (Sampel belum turun), Botol II : Kuning (Sampel turun), Botol III : Bening
(Sampel turun) dan Botol IV : Bening Setiap botol dibiarkan menguap dan
kemudian ditetesi dengan metanol. kemudian dilanjutkan dengan kromatografi
lapis tipis. Hasilnya, pada plat terlihat bahwa crude terjadi fasa gerak
berwarna orange. Botol I : tidak terjadi apa-apa, Botol II : tidak bergerak
tetapi terdapat warna cream pudar, Botol III : bergerak dengan warna cream dan
Botol IV : tidak bergerak tetapi ada
warna cream pudar pada plat.
v Pada sampel selanjutnya kentang. Disiapkan pelarut
kloroform : metanol = 3 : 1.Kemudian kolom yang telah terisi dengan silika gel
yang memadat ditambahkan sampel bunga kertas yang kering dan tetesi dengan
pelarut tersebut secara perlahan Dimasukkan secara terus menerus dan perlahan.
Disiapkan wadah untuk pelarut yang turun. Diperoleh hasil : Botol I : bening (
setengah botol), Botol II : kuning keruh ( seperdelapan botol), Botol III :
bening dan Botol IV : bening Setiap botol dibiarkan menguap dan kemudian
ditetesi dengan metanol. kemudian dilanjutkan dengan kromatografi lapis tipis.
Hasilnya pada plat terdapat fasa gerak pada crude namun pada sampel hasi
kromatografi kolom tidak terjadi apa-apa.
v Pada sampel selanjutnya tomat. Disiapkan pelarut
kloroform : metanol = 3 : 1.Kemudian kolom yang telah terisi dengan silika gel
yang memadat ditambahkan sampel bunga kertas yang kering dan tetesi dengan
pelarut tersebut secara perlahan Dimasukkan secara terus menerus dan perlahan.
Disiapkan wadah untuk pelarut yang turun. Diperoleh hasil bahwa : Botol I :
berwarna bening, Botol II : berwana kemerahan dan Botol III : bening. Setiap
botol dibiarkan menguap dan kemudian ditetesi dengan metanol. kemudian
dilanjutkan dengan kromatografi lapis tipis. Hasilnya pada plat diperoleh bahwa
botol III bergerak dan berwarna bu-abu.
v Pada sampel selanjutnya yaitu bunga sepatu.
Disiapkan pelarut kloroform : metanol = 3 : 1. Kemudian kolom yang telah terisi
dengan silika gel yang memadat ditambahkan sampel bunga kertas yang kering dan
tetesi dengan pelarut tersebut secara perlahan Dimasukkan secara terus menerus
dan perlahan. Disiapkan wadah untuk pelarut yang turun. Diperoleh hasil : Botol
I : bening, Botol II : keruh dan Botol III: keruh pudar. Setiap botol dibiarkan
menguap dan kemudian ditetesi dengan metanol. kemudian dilanjutkan dengan
kromatografi lapis tipis. Hasilnya pada plat tidak terjadi fasa gerak tetapi
terdapat warna cream.
Dari
beberapa sampel diatas dapat terlihat bahwa perbedaan laju turun dari
masing-masing sampel dalam kolom dan beberapa percobaan berdasarkan pemisahan
dengan kromatografi kolom didasarkan kekuatan adsorpsi atau daya serap dari
koefisien partisi antara fasa gerak dan fasa diam. Pengaruh lain disebabkan
oleh fasa gerak yang digunakan dalam proses tersebut berdasarkan kepolarannya.
IX.
Pertanyaan Pasca Praktikum
- Mengapa dalam percobaan tersebut
praktikan mengunakan silica gel dalam percobaan kromatografi kolom?
- Apa prinsip dari kromatografi lapis tipis diatas?
- Apa kegunaan dimasukkannya
n-heksana ke kolom dalam percobaan kromatografi kolom?
XII.
Kesimpulan
Adapun
kesimpulan dari praktikum ini, yaitu:
- Kromatografi adalah salah satu proses pemisahan molekul-molekul berdasarkan fase
gerak dan fase diamnya dalam suatu larutan.
- Kelebihan dari kromatografi lapis tipis dibanding kolom adalah :
pengerjaannya membutuhkan waktu yang cepat, bahan yang diperlukan bisa di
sesuaikan dengan kebutuhan, serta proses pemisahannya berlangsung baik.
- Teknik pemisahan kromatografi ini
juga digunakan untuk menentukan nilai Rfnya dengan rumus sebagai berikut:
XIII. Daftar Pustaka
Budiasih,
2008. Hanbook Ibu Menyusui. Bandung: Karya Kita.
Endang
& Erma, 2010. Kimia Organik. Jakarta: Erlangga.
Gitter,
2011. Fisiologi Lingkungan Tanaman. Diterjemahkan oleh Sri Andani dan E. D.
Purbayanti. Gadjah Mada University Press. Yogyakarta
Ratnayani,dkk, 2013. Aktivitas
Antiradikal Bebas Serta Kadar Beta Karoten pada MaduRandu (Ceiba Pentandra)
dan Madu Kelengkeng (Nephelium Longata L.), Jurnal Kimia, 4 (1),
Januari 2010 : 54-62
XIV.
Lampiran Gambar
Pengekstrakan Sampel
Hasil pengekstrakan dari sampel
Perendaman Plat pada eluen
Penyinaran sinar UV pada plat TLC
Proses kromatografi kolom